NISSHA メディカルテクノロジー事業部は米国・欧州市場向けの医療機器開発において豊富な実績と経験を持っています。特に米国市場に向けた医療機器の開発では、FDAが推奨する医療機器開発ガイドライン(FDA 21 CFR 820.30)に準拠していることが求められます。ガイドラインの中の一つに、ウォーターフォール型の開発プロセスがあり、要点について簡単に解説します。
米国医療機器市場におけるFDAの役割
医療機器の製造、販売を行う際には、公的機関、登録認証機関から認証、承認を受ける必要があります。
日本国内では、「PMDA:独立行政法人医薬品医療機器総合機構」において、医薬品、医療機器などの承認審査が行われています。
米国では、「FDA(Food and Drug Administration):アメリカ食品医薬品局」がこの役割を担っています。
FDAは、HHS(アメリカ合衆国保健福祉省)の一機関で、日本の厚生労働省に該当する公的機関です。食品、医薬品、動物薬、化粧品、医療機器、玩具などの安全性、有効性を確保するため、検査、承認審査、取締りなどを行っています。
日本で製造された医療機器を米国市場に輸出する場合には、FDAに登録、届出または承認を取得する必要があります。
| クラスⅠ | |
|---|---|
| 体にダメージを与えるリスクが極めて低いもの | 品質管理規則への準拠、施設登録、製品登録 |
| クラスⅡ | |
| 負傷するリスクがあるもの | 品質管理規則への準拠、市販前の届出(510K)、GMP審査 |
| クラスⅢ | |
| 深刻な障害を起こすことや、死にいたることも想定されるもの | 臨床試験(IDE)、市販薬の承認(PMA)、GMP審査 |
日本では、人体へのリスクに応じて一般医療機器、管理医療機器、高度管理医療機器の3つに分類され、届出、第三者認証、大臣承認(PMDAで審査)が必要になります。米国では、第三者認証の制度は無く、同じ医療機器の場合でもクラス分類が異なる場合があるので確認が必要です。
ウォーターフォール型プロセスによる医療機器の開発
FDAは、医療機器が品質管理規則(QSR:Quality System Regulation)に準拠していることを要求しています。
品質管理規則では、医療機器が適切な仕様と管理に基づき、開発、設計、製造されていることを求めています。
これに伴い、医療機器メーカーは、各製品に応じた品質管理システムを確立し、維持しなければなりません。
医療機器の開発、設計において、FDAは、医療機器メーカーに対してウォーターフォール型プロセスを推奨しています。米国でのクラスⅡ以上(一部クラスⅠの品目は対象)の設計管理において、医療機器開発ガイドライン(FDA 21 CFR 820.30)にも明記されております。
医療機器を含めた一般的な製造業における開発、設計では、使用者の要求に基づいて仕様を決めて設計を行い、試作、評価を何度か繰り返して完成品としていく「スパイラル型」のプロセスが多く行われています。
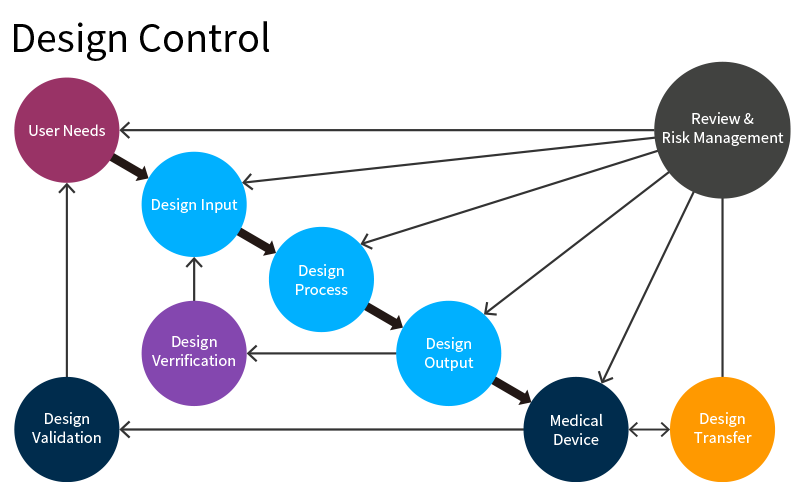
ウォーターフォール型プロセスでは、最初に要求定義として「使用者の要求」と「意図した用途」を決めます。
医療従事者や患者さまの定性的な要求を出発点とし、定量的な定義を行う設計インプット、それを実現するための設計プロセスを通した設計アウトプットの各段階でレビューを行い、各要素の関連付けを文書として結果を残しながら進め、完成品を終着点として開発、設計を進めていきます。
各段階を確実に実施して進めるので後戻りは許されず、何度も戻ることにより起こる設計ミスを防ぐことになります。人の命にかかわる医療機器であるからこそ少しのミスも許されず、FDAではスパイラル型ではなくウォーターフォール型プロセスでの開発、設計を推奨しています。
バリデーションとベリフィケーションの使い分け
ウォーターフォール型プロセスでは、ベリフィケーション(検証)とバリデーション(妥当性確認)が行われます。
ベリフィケーションは、設計インプットどおりに設計アウトプットができているかを確認します。例えば「片手で持てるように軽くしたい」という使用者の要求を「重量を〇〇以下に抑える」と設計インプットで定義し、その設定した仕様を満たす設計を行う過程が対象になります。
設計インプットが計画通りに設計が行われていたかを検証し、文書として残すことで、開発、設計が正しい手順で行われていたことを保証します。

NISSHAの医療機器開発体制
NISSHA メディカルテクノロジー事業部(Nissha Medical Technologies)は高度管理医療機器から医療用ケーブル、米国などで注目されているウェアラブル・生体センサーなどの医療機器の受託設計・製造を長年に渡り展開しています。

Nissha Medical Technologiesのデザインチームは、設計管理と品質管理システムを確立、維持し、FDAのガイドラインに沿う開発を日々実践しています。
また、色々なお客さまの設計・開発案件に携わっている為、幅広い臨床分野での知見を蓄積しています。さらに、3Dシミュレーションツールや検証方法を用いて早い段階で多くの問題点やリスクを洗い出して対応するフロントローディング型の開発により、開発の初期の段階から最後まで、高い設計品質で製品を完成させていきます。
日本国内向けはもちろん、海外向けの医療機器の開発・製造において、多くの知識と経験を持つNISSHA メディカルテクノロジー事業は、医療機器の開発・製造パートナーとして、幅広くサポートします。